一:可逆反应:
举例:合成氨

可逆反应:在同一条件下可向正逆两个方向进行的化学反应。这里的重点是条件同一,如果条件不一致就不是可逆反应。
如下:不是可逆反应!!

在可逆反应中:
从左到右叫做正反应,从右到左叫做逆反应。
大多数反应都是可逆反应,不同反应只不过可逆程度不同而已。
二:化学平衡
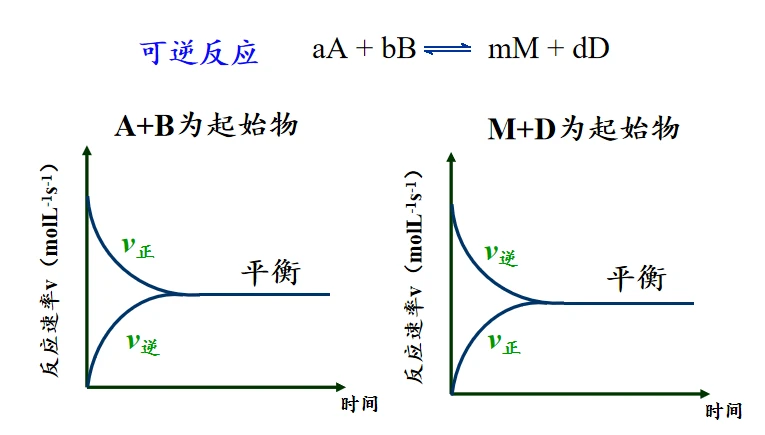
AB为起始物时,最初浓度很高,所以从左往右的反应进行的速率快,
随着反应物的减少,浓度下降,正反应的速率下降。
同时生成物的浓度上升,因此逆反应的速率上升。
最终二者处于动态平衡。
MD为起始物时,也是如此。
————
化学平衡定义:
可逆反应在一定条件下,正逆反应速率相同,反应混合物中的各组分成分相同的含量保持不变的状态
特点:
1:可逆反应
2:正逆反应速率相等
3:动态平衡
4:体系组成成分一定
5:条件相同时,最终的平衡与途径无关,
6:条件改变时,最终的平衡移动
三:平衡常数
对某一可逆反应,在!一定温度!下,无论反应物的起始浓度如何,反应达到平衡状态后,生成物与反应物浓度系数次方的比是一个常数,称为化学平衡常数K
K值的大小表示反应进行的程度,K值越大表示反应程度越大,也就是生成物的含量越多。
(1)
实验平衡常数:

类推:
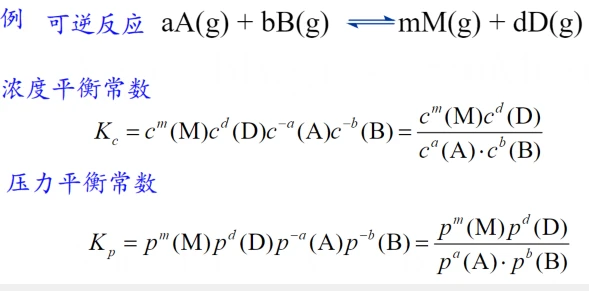
压力平衡常数与浓度平衡常数之间存在关系:
由p=nRT/V=CRT
Kp=Kc(RT)m+d-a-b
显然浓度平衡常数与压力平衡常数不同
在单位上和数值上都不同。
(2)标准平衡常数
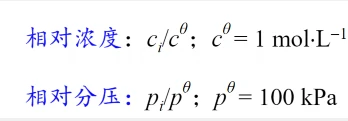
标准平衡常数:


(3)多重平衡规则:(与盖斯定律类似但是不同)
一个给定反应计量方程式的平衡常数,无论反应分几步完成,其平衡常数的表达式完全相同,也就是说某个总反应分为几个反应之和或之差时,则总反应的平衡常数为这若干个分步反应平衡常数的乘积或商。标准反应常数与途径无关只和始态末态有关

这个(3)=(2)-(1)就是左边减去左边,右边减去右边
如果正向求出了标准平衡常数为k,那么逆向求出的标准平衡常数就为他的倒数。
四:化学反应进行的方向的反应熵判断
(1)

Q的任意态即反应的任何时候,可能正在进行,可能正反应速率还很大,总而言之还没达到平衡,当达到平衡时,Q=Kθ
判断化学反应方向
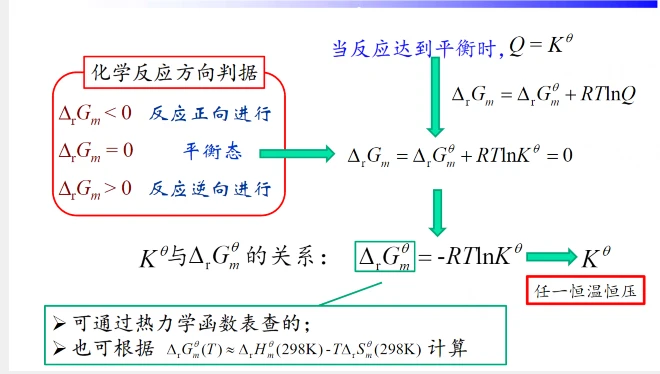
查表查到的始生成焓,通过盖斯定律得出反应焓。

也就是说:kθ的越大生成物越多
(2)
化学反应的等温式:

五:化学平衡移动

kθ大就是往正反应方向移动
六:化学平衡的影响因素:
浓度或气体分压,压力,温度
(1)浓度或气体分压:
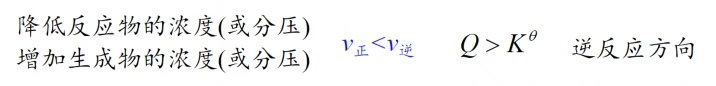
(2):压力:(对液体和固体影响不大)




重点就是组分分压Pb是否改变,是怎么变化的,增大还是减小,还有气体的物质量的变化。
(3)温度:
温度改变的的是标准平衡常数,而不和压力,浓度或气体分压改变的Q
温度通过改变标准平衡常数是的平衡移动。

对于吸热反应:升高温度,平衡右移
对于吸热反应:降低温度,平衡左移
对于放热反应:降低温度,平衡右移
对于放热反应:升高温度,平衡左移
压强增大,平衡往分子数减少方向移动
压强减小,平衡往分子数增多方向移动
增大反应物浓度或者分压,平衡右移
减小生成物浓度或者分压,平衡右移
增大生成物浓度或者分压,平衡左移
减小反应物浓度或者分压,平衡左移

(4)催化剂的作用

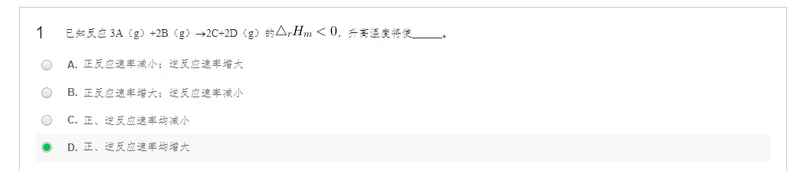
升高温度两边速率都增加
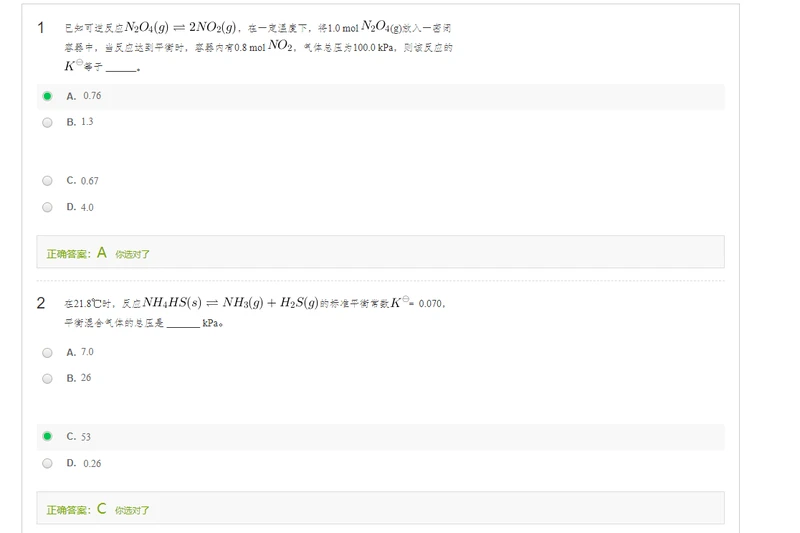
第一题:根据转化求出每个物质的两,再利用分压定律,再求标准平衡常数
第二题:注意固体再求标准平衡常数时视为1
所以0.07是由后两个的乘积所得,然而后两个物质的浓度相同。
第三题:
增大压强反应向气体分子减少的方向移动
放热反应,降低温度反应向右偏移
