分子间相互作用力——氢键,卤键,硫键,π-π堆积,盐桥,阳离子-π,疏水作用力
理解分子间相互作用力的重要性
- 解释构效关系
- 提供先导化合物优化 / 分子构造思路
- 辅助发展打分函数
氢键
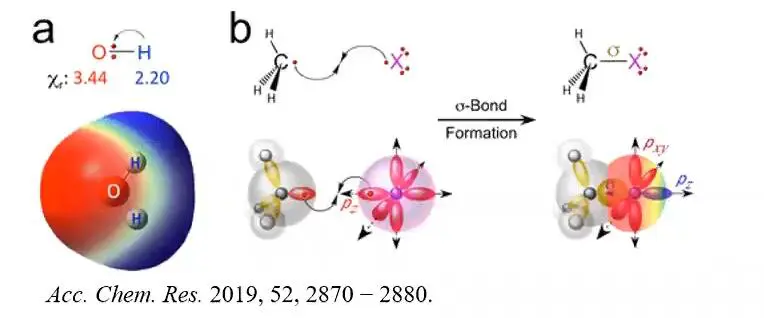
定义:与N,O,F等强电负性元素相连的氢与富电子基团所形成的吸引作用。一般形式为
D
−
H
D-H
D−H

一般来说,D为N,O,F为典型的氢键,其他的(C、S、Cl、P甚至Br和I原子在某些情况下也能形成氢键)为非典型的氢键。X的电负性要大于氢。
卤键
氢键:
D
−
H
⋅
⋅
⋅
A
D-H···A
D−H⋅⋅⋅A
卤键:
D
−
X
⋅
⋅
⋅
A
D-X···A
D−X⋅⋅⋅A
D代表的电子给体(可以是原子、原子团、分子),即Lewis碱,它们将电子提供给显正电性的氢原子或卤原子。相比氢键,卤键具有显著的方向性。
硫键
二硫键在一些蛋白质的折叠及稳定性占有重要的地位。蛋白质的二硫键是在半胱氨酸残基的硫醇之间形成,其他含有硫的氨基酸——蛋氨酸就不能形成二硫键。
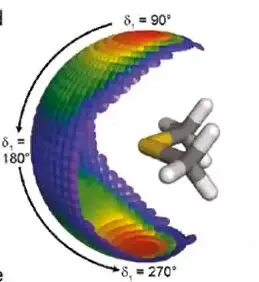
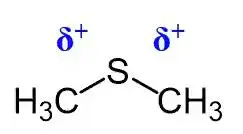 上图中,共价键反向延长方向存在σ-hole(分子静电式表面)
上图中,共价键反向延长方向存在σ-hole(分子静电式表面)
σ-hole存在于卤素原子X的头部,R-X,x本身带负电,但是其头部由于电子的缺少,会有一个正电荷区域。
π-π堆积
定义:π-π堆积是芳香化合物的一种特殊空间排布,指一种常常发生在芳香环之间的弱相互作用,通常存在于相对富电子和缺电子的两个分子之间,是一种与氢键同样重要的非共价键相互作用。
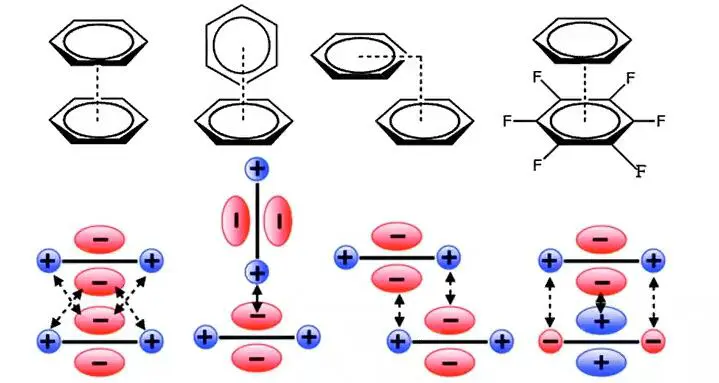 注:堆积对象不局限在芳环中,对其他共轭体系也适用。如胍基、酰胺、碳碳双键等。
注:堆积对象不局限在芳环中,对其他共轭体系也适用。如胍基、酰胺、碳碳双键等。
阳离子-π
共轭体系与阳离子之间的相互作用。
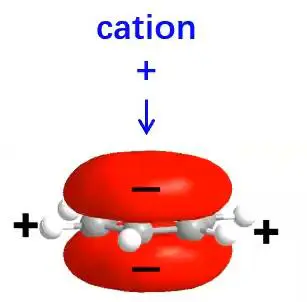
疏水作用
疏水作用是指水介质中球状蛋白质的折叠总是倾向于把疏水残基埋藏在分子内部的现象。
也可以说,相互作用双方结合过程中去溶剂化释放结合水引起的熵增,所带来的自由能 的变化。
盐桥
带异种电荷基团之间的吸引作用,也可视为离子键,
如
L
y
s
—
—
N
+
H
3
Lys ——N^+ H_3
Lys——N+H3 ······
−
O
O
C
—
—
G
l
u
^- OOC——Glu
−OOC——Glu
