CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显着的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR 。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1. Science和Cell子刊:借助大数据开发出治疗癌症的“智能”细胞疗法
doi:10.1016/j.cels.2020.08.002; doi:10.1126/science.abc6270
寻找既能杀死癌细胞又能让正常组织不受伤害的药物是肿瘤学研究的最高目标。在两篇新的论文中,来自美国加州大学旧金山分校和普林斯顿大学的研究人员提出用“智能(smart)”细胞疗法激活成功教程这一难题的互补策略:除非被仅在癌细胞中同时出现的一组蛋白所激活,否则这些活的细胞药物会保持惰性。
这种通用方法的生物学方面已经在Wendell Lim博士及其同事们在加州大学旧金山分校细胞设计计划和美国国家癌症研究所赞助的合成免疫学中心的实验室中探索了好几年。但是,他们的新研究通过将前沿的治疗细胞工程与先进的计算方法相结合,为这方面增加了一个强大的新维度。
在第一篇发表在2020年9月23日的Cell Systems期刊上的标题为“Discriminatory Power of Combinatorial Antigen Recognition in Cancer T Cell Therapies”的论文中,Lim实验室的成员与普林斯顿大学路易斯-西格勒综合基因组学研究所计算机科学家Olga G. Troyanskaya博士的研究小组联手。通过使用机器学习方法,他们分析了在癌症和正常细胞中发现的数千种蛋白的海量数据库。随后,他们筛选了数百万种可能的蛋白组合,以构建出一个蛋白组合目录,可用于精确地只靶向癌细胞,而不靶向正常细胞。
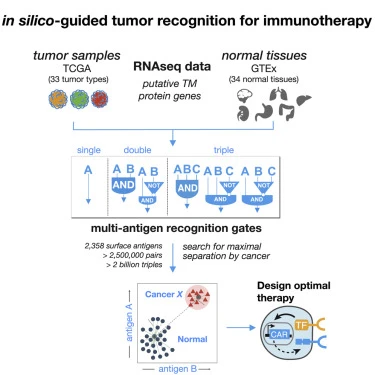
图片来自Cell Systems, 2020, doi:10.1016/j.cels.2020.08.002。
在第二篇发表在2020年11月27日的Science期刊上的标题为“Precise T cell recognition programs designed by transcriptionally linking multiple receptors”的论文中,Lim及其同事们随后展示了如何将这些通过计算得出的蛋白数据用于推动设计有效和高度选择性的癌症细胞疗法。
2.Science子刊详解:临床试验表明靶向GD2的CAR-T细胞有望治疗神经母细胞瘤
doi:10.1126/scitranslmed.abd6169
在一项新的研究中,来自英国大奥蒙德街儿童医院和伦敦大学学院等研究机构的研究人员开发出一种旨在靶向癌性肿瘤的新型CAR-T细胞疗法,它在患有神经母细胞瘤(一种罕见的儿童癌症)的儿童身上显示出有希望的早期结果。相关研究结果发表在2020年11月25日的Science Translational Medicine期刊上,论文标题为“Antitumor activity without on-target off-tumor toxicity of GD2–chimeric antigen receptor T cells in patients with neuroblastoma”。
在这项原则性验证研究中,这些作者对患者自身的T细胞(一种免疫细胞)进行了基因改造,使之具备识别和杀死神经母细胞瘤细胞的能力。12名复发性或难治性神经母细胞瘤儿童接受了这种治疗,这是英国癌症研究中心资助的I期临床试验的一部分。
这项研究是首批证明CAR-T细胞实现实体癌快速消退的研究之一。虽然有益效果只持续了很短的时间,但是它提供了重要的证据表明这种特殊的CAR-T细胞疗法可以作为未来治疗儿童实体癌的方法。
3.新纯化方法有望降低CAR-T细胞的制造成本和毒副作用
新闻来源:New approach to fighting cancer could reduce costs and side effects
澳大利亚南澳大学未来产业研究所博士生Mona Elsemary开发出一种微流体方法来纯化嵌合抗原受体(CAR)T细胞(CAR-T)。CAR-T细胞是经过基因改造的T细胞,也是突破性细胞免疫疗法的基础。CAR-T细胞疗法是一种利用患者免疫系统的力量来对抗癌症的变革性免疫疗法。
人淋巴细胞的电子显微图,图片来自Dr. Triche/National Cancer Institute。
Elsemary说,“CAR-T细胞疗法已经在治疗血癌方面取得了一些显着的成果,目前有大量国际研究正在努力将这一成功转化为针对实体癌的CAR-T细胞疗法。然而,CAR-T制造过程仍然存在重大障碍和成本高昂,这阻止了这种救命疗法的全部潜力得到实现。”这些问题包括细胞制剂中存在没有活力的细胞和细胞碎片,以及通常用于CAR-T细胞产品冷冻和储存的冷冻保护剂(比如二甲基亚砜)。
这种微流体方法是由南澳大学的Benjamin Thierry教授及其团队与悉尼科技大学Benjamin Thierry副教授合作开发的,可以在30分钟内剔除CAR-T细胞产品中70%以上的死细胞,并让细胞活力平均提高20%。此外,超过90%的冷冻保护剂二甲基亚砜被去除---所有这些都不会对这些细胞的质量和功能产生不利影响。
4. Cancer Cell综述文章解读!如何对CAR-T细胞工程化修饰开发新一代的癌症疗法?
doi:10.1016/j.ccell.2020.07.005
日前,一篇发表在国际杂志Cancer Cell上题为“Engineering CAR-T Cells for Next-Generation Cancer Therapy”的综述文章中,来自加利福尼亚大学等机构的科学家们论述了如何对CAR-T细胞进行工程化修饰以用作新一代的癌症疗法。
经过工程化修饰能表达具有肿瘤特异性的嵌合抗原受体(CARs)的T细胞在治疗恶性血液肿瘤患者方面取得了显着的疗效,同时还给过继细胞疗法(adoptive cell therapy)研究领域带来了革命性的突破,然而实现CAR-T细胞更广泛的治疗性应用还需要多层次的工程化方法来提高治疗的疗效和安全性,尤其是由于实体瘤微环境(tumor microenvironment,TME)的生物复杂性常常会给其治疗带来独特的挑战性,这篇综述文章中,研究人员论述了如何通过工程化修饰CAR蛋白、T细胞、T细胞和TME中其它组分之间的相互作用来改善CAR-T细胞疗法的最新策略。
嵌合抗原受体(CARs,chimeric antigen receptors)是一种合成性的受体,其能促进T细胞以一种主要组织相容性复合体(MHC)依赖性的方式来识别肿瘤相关抗原(TAAs )。以泛B细胞标志物CD19为靶点的CAR-T细胞在治疗难治性B细胞恶性肿瘤方面能表现出前所未有的反应率,同时其也成为了首个获得美国FDA批准的基于遗传修饰的细胞疗法;然而,开发治疗非B细胞恶性肿瘤的有效CAR-T细胞疗法还需要更为复杂的工程化手段来克服肿瘤的防御性机制,比如免疫抑制、抗原逃逸和进入实体瘤的物理屏障等;这篇文章中,研究人员旨在重点关注如何改善过继T细胞疗法治疗实体瘤的疗效和安全性。
文章中,研究人员从以下几方面进行了论述:1)CAR设计的进化史;2)针对逻辑门控T细胞激活的组合性抗原活化;3)开启/关闭开关的可控性和安全性;4)适配器依赖性的CARs;5)CAR-T细胞活性的安全性控制;6)调节CAR的表达用于改善CAR-T细胞的安全性;7)位点特异性的CAR转基因插入及异基因兼容工程化修饰;8)促进T细胞功能的转基因表达;9)肿瘤微环境中CAR-T细胞的自分泌刺激;10)肿瘤的归巢和渗透;11)免疫抑制轴的破坏;12)重塑肿瘤微环境来促进内源性的免疫反应。
5.新研究表明多发性骨髓瘤患者在接受CAR-T细胞治疗之前接受放疗似乎是安全的,而且不会影响CAR-T细胞的疗效
新闻来源:Penn Study supports use of radiation before CAR therapy for multiple myeloma
在一项新的研究中,来自美国宾夕法尼亚大学艾布拉姆森癌症中心的研究人员发现对等待CAR-T细胞制造的多发性骨髓瘤患者给予放疗被发现是安全的,并且不会破坏CAR-T细胞治疗,相关研究结果于2020年10月27日在虚拟的美国放射肿瘤学会年会上发表。
这项研究发现,在输注BCMA CAR-T细胞(即靶向BCMA抗原的CAR-T细胞)34天前或更短的时间内接受放疗的患者中,他们的严重细胞因子释放综合征(CRS)或神经毒性(细胞治疗的两种常见副作用)和血液学毒性的发生率并不比没有接受放疗的患者差。
针对复发/难治性多发性骨髓瘤的放疗通常用于缓解与这种疾病相关的骨痛,然而,它对患者和CAR-T细胞治疗可能产生的影响还没有完全了解。这些新的研究结果表明,在患者接受CAR-T细胞输注之前,放疗似乎是一种安全的治疗选择,这就为将放疗和细胞治疗相结合的未来研究提供了更多的支持。
这项研究是对宾夕法尼亚大学艾布拉姆森癌症中心与诺华公司合作项目的回顾性分析,评估了25名接受BCMA CAR-T细胞治疗的患者的医疗记录,并将他们分为三组。一组患者在他们的T细胞被采集用于BCMA CAR-T细胞制造后,但在输注这些BCMA CAR-T细胞34天前或更短的时间内接受了放疗。第二组患者在BCMA CAR-T细胞输注一年前内接受过放疗。第三组患者在BCMA CAR-T细胞输注一年前内没有接受放疗。
在等待BCMA CAR-T细胞制造期间接受放疗的4名患者中,没有一人出现高于3级的CRS、胃肠道、传染性、肝脏相关或神经系统毒副作用。CRS是一种毒副作用,包括不同程度的流感样症状,伴有高烧、恶心和肌肉疼痛,有可能需要重症监护。这些患者的4级血液毒副作用发生率也较低。在8名既往有放疗史的患者中,有3人出现了3级或更高的CRS。在13名未接受任何放疗的患者中,有5人发生3级或更高的CRS。放疗状态与总生存期或无进展生存期的下降无关。
6. JEM:新研究提高CAR-T靶向治疗的检测灵敏度
doi:10.1084/jem.
在最近一项研究中,路德维希癌症研究的科学家们已经开发出一种方法,可以显着改善嵌合抗原受体(CAR)T细胞疗法的临床前评估,该方法是从患者体内提取免疫系统的T细胞,并设计为靶向特定的肿瘤相关分子,然后生长并重新注入以治疗癌症。该研究发表在《Journal of Experimental Medicine》杂志上,研究还报告了共同设计的CAR-T细胞的构建和评估,并将该方法应用于检查其在皮肤癌黑色素瘤小鼠模型中对肿瘤的作用。
尽管CAR-T疗法已被批准用于血液癌症,但将其应用于实体瘤却被证明具有挑战性。部分原因是实体瘤的复杂微环境以多种方式抑制了免疫反应。
“大多数CAR-T疗法的研究都是在缺乏自身免疫系统的小鼠中完成的,因为如果这些小鼠具有正常免疫系统,它将攻击人类CAR-T细胞,”研究人员Melita Irving说路德维希癌症研究所洛桑分校与路德维希·洛桑主任George Coukos共同领导了这项研究。“但是肿瘤微环境可能会对T细胞产物产生巨大影响,因此我们希望免疫能力强的小鼠中使用工程改造的小鼠T细胞进行研究。这使我们能够同时观察免疫系统与CAR- T细胞。”
问题在于,要严格模拟CAR-T细胞疗法所需的数量,很难对小鼠T细胞进行改造和使其在培养中达到最佳状态。对于当前的研究,路德维希·洛桑团队首先制定了克服这些困难的方案。除其他事项外,它涉及在工程化T细胞的培养和扩增中顺序使用三种称为白介素(IL-2、7和15)的免疫信号分子。
他们表明,使用该方法培养的CAR-T细胞在暴露于其靶标后会被显着激活。这些细胞还显示出更年轻的迹象,并具有记忆T细胞共有的分子特征,当受到靶标刺激时,它们会迅速生长。
7. Science子刊:转录因子STAT5持续激活可提高CAR-T细胞的抗肿瘤免疫反应
doi:10.1126/sciimmunol.aba5962
使用嵌合抗原受体(CAR)T细胞(CAR-T)的过继性细胞疗法显示出强大的抗肿瘤免疫力,但T细胞衰竭可能损害它们的疗效。多功能性CD4+ T细胞的存在通常与良好的抗肿瘤免疫力有关。科学家们之前发现IL-7处理可诱导产生多种细胞因子的多功能性CD4+ T细胞激活。
在一项新的研究中,来自美国奥古斯塔大学等研究机构的研究人员报告,肿瘤特异性CD4 + T细胞中的转录因子STAT5持续激活驱动了多功能性T细胞的产生。相关研究结果发表在2020年10月30日的Science Immunology期刊上,论文标题为“Persistent STAT5 activation reprograms the epigenetic landscape in CD4+ T cells to drive polyfunctionality and antitumor immunity”。
图片来自CC0 Public Domain。
他们发现,小鼠STAT5A的组成型活性形式(constitutively active form of murine STAT5A, CASTAT5)的异位表达使得肿瘤特异性CD4 + T细胞能够进行稳健的扩增,强效地浸润肿瘤,并在CD4 + T细胞过继转移模型系统中引发抗肿瘤CD8 + T细胞反应。
综合表观基因组学和转录组学分析表明,CASTAT5诱导了CD4 + T细胞中全基因组范围内的染色质重塑,并建立了独特的表观遗传学和转录景观。单细胞RNA测序分析进一步鉴定了CASTAT5转导的CD4 + T细胞的一个亚群,该亚群具有指示多功能性T细胞祖细胞(progenitor polyfunctional T cell)的分子特征。
这些研究人员发现在小鼠B细胞淋巴瘤模型中,经过改造后共同表达CASTAT5和靶向CD19的嵌合抗原受体(CAR)的T细胞的过继转移导致多功能性CD4 + CAR-T细胞产生。这一发现使得CASTAT5具有潜在的治疗意义。
8.Nat Med:I期临床试验表明双特异性CD19/CD20 CAR-T细胞有望治疗复发性B细胞恶性肿瘤
doi:10.1038/s41591-020-1081-3
嵌合抗原受体(CAR)T细胞(CAR-T)疗法被认为是治疗多种类型肿瘤的突破性技术。非霍奇金淋巴瘤(Non-Hodgkin lymphoma, NHL)和慢性淋巴细胞白血病(CLL)是两种CD19阳性的B细胞癌症,已经用识别CD19的CAR-T细胞进行治疗。虽然CD19是位于B细胞表面上的经典分子,但是仅靶向CD19会导致它的表达下调的方法经常遭遇治疗失败。
为了克服这一局限性,Shah等人在一项新的研究中利用一种自动化细胞处理平台开发出双特异性靶向CD19和CD20的CAR-T细胞(下称CD19/CD20 CAR-T细胞)疗法。
这项研究是一项1期剂量递增和扩大临床试验。在这项临床试验中,利用这些双特异性CAR-T细胞治疗NHL或CLL患者。基于此,本临床研究中纳入了26名此前经历多次抗B细胞治疗而遭遇失败的患者。总的来说,这种双特异性CAR-T细胞疗法被认为在治疗上是安全的。分别有64%和32%的患者出现细胞因子释放综合征和神经毒性。总体反应率为82%,12名接受高剂量、新鲜制备的CD19/CD20 CAR-T细胞的患者均有反应。相反,43%接受低温保存CD19/CD20 CAR-T细胞的患者遭遇治疗失败。这表明,使用新鲜制备的CD19/CD20 CAR-T细胞可能是治疗成功的关键。最后,3名患者对这种治疗没有反应。所有无应答者均表现出高水平的循环CAR-T细胞,这提示着存在抗原刺激,但是这些CAR-T细胞的杀伤活性明显下降。
9.重磅!科学家成功制造出新型CAR-NKT细胞 或有望开发新型免疫疗法治疗实体瘤
doi:10.1038/s41591-020-1074-2
自然杀伤性T细胞(NKT)是一类被证明在鼠类肿瘤模型中具有潜在抗癌特性的免疫细胞,如今研究人员有望利用NKT细胞开发一种新型免疫疗法来治疗癌症患者。近日,一篇发表在国际杂志Nature Medicine上题为“Anti-GD2 CAR-NKT cells in patients with relapsed or refractory neuroblastoma:an interim analysis”的研究报告中,来自贝勒医学院等机构的科学家们通过研究利用嵌合抗原受体(CAR)对人类NKT细胞进行遗传修饰,从而就能特异性地识别并攻击神经母细胞瘤(一种儿童癌症),修饰后的NKT就能表达白介素-15(IL-15),其是一种能支持NKT细胞生存的天然蛋白。
这项研究中,研究人员公布了一项正在进行的临床试验的中期结果,结果表明,修饰后的NKT细胞是安全的,其能定植到肿瘤中,在受试的三名患者中,有一名患者机体成功诱导除了对骨转移病灶退化的客观反应。最早的CAR修饰细胞是免疫T细胞,CAR T细胞被证明能有效治疗白血病和淋巴瘤,然而科学家们在尝试利用CAR T细胞治疗实体瘤的过程中却遭遇了一些挑战,临床前研究结果表明,NKT细胞能提供一种新方法来帮助增强CAR导向的癌症免疫疗法。
研究者Leonid Metelitsa教授说道,除了能在小鼠模型机体中有效抵御肿瘤外,NKT细胞在实体瘤中的存在也与癌症患者有利的结果直接相关。此前研究结果表明,NKT细胞拥有广谱的抗肿瘤活性,比如,这些细胞能迁移到肿瘤位点,在那里杀灭肿瘤相关的巨噬细胞等,而巨噬细胞是一类能促进肿瘤生长和转移的免疫细胞,此外,NKT细胞的激活还能间接促进NK细胞和T细胞所介导的抗肿瘤免疫反应。
10.elife:T细胞抗癌新机制
doi:10.7554/eLife.56554
一项在《eLife》杂志上发表的最新研究表明,当免疫系统中的T细胞找到并识别出靶标时,它们会释放化学物质以吸引更多T细胞,然后聚集起来帮助抑制这种威胁。
图片来源:Www.pixabay.com。
这种群聚行为的发现,以及T细胞用来将更多的T细胞引向肿瘤的化学引诱剂,有一天可以帮助科学家开发出能增强免疫系统的新癌症疗法。对于实体瘤而言,这尤其重要。到目前为止,实体瘤对目前的免疫疗法的反应要比血液癌症低。
研究小组使用在实验室和小鼠模型中生长的3-D肿瘤模型,表明杀死癌症的T细胞可以独立于中间免疫细胞而驻留在肿瘤细胞中。当T细胞发现并识别出肿瘤时,它们会释放化学信号,然后吸引更多的T细胞通过一种称为CCR5的受体感知信号,并引起群集反应。GaleanoNiño说:“这些细胞协调着它们的迁移过程,使人想起了在某些昆虫和另一种称为中性粒细胞的免疫细胞群中观察到的群聚行为,它有助于机体对伤害和病原体做出反应。”
在使用计算机模型确认其结果后,该小组对人类细胞进行了基因工程改造,称为嵌合抗原受体(CAR)-T细胞,并证明它们也涌向实验室中生长的3-D胶质母细胞瘤肿瘤。CAR-T细胞目前正用于治疗某些类型的血液癌。但是新发现表明,也有可能训练这些细胞攻击实体瘤。
11.Nat Cancer: 免疫疗法可治疗罕见眼部癌症
doi:10.1038/s43018-020-00119-y
在最近一篇文章中,研究人员发现使用CAR-T细胞与可注射凝胶中包装的增强免疫力药物相结合的治疗方法,可以挽救植入了人源成视网膜细胞瘤组织的小鼠的视力。2020年10月12日,《Nature Cancer》杂志发表了北卡罗来纳大学Lineberger大学综合癌症中心科学家的研究结果。
首先,研究人员尝试了嵌合抗原受体-T(CAR-T)细胞疗法,这是一种免疫疗法,其中包含免疫系统的T细胞在实验室中经过修饰,可以表达靶向癌症表面蛋白的嵌合抗原受体CARs。在实验室测试中,他们发现在视网膜母细胞瘤中表达了一种分子GD2,但靶向该分子以安全消除眼中肿瘤的可能性尚不清楚。
接下来,为了测试靶向GD2的安全性和益处,研究人员将识别该分子的CAR-T注入植入了成视网膜细胞瘤癌细胞的小鼠的视网膜中,发现该疗法延迟了肿瘤的发展,但并未根除肿瘤。然后,他们将CAR-T与白细胞介素(IL)-15(一种可以增强免疫反应的蛋白质)结合使用,发现60%的小鼠在长达70天的时间内无肿瘤。
最后,他们将含有CAR-Ts和IL-15的水基凝胶注射到小鼠的视网膜中。CAR-T和IL-15保留了攻击癌细胞,控制肿瘤生长和预防肿瘤复发的扩展能力。他们通过对视网膜进行的几次影像检查证实了肿瘤生长的受限。
12.Nat Med:CAR-T细胞治疗大B细胞淋巴瘤患者的特征
doi:10.1038/s41591-020-1061-7
近日,德克萨斯大学MD安德森癌症中心的研究人员已经确定了CD19 CAR T细胞治疗的相关分子和细胞特征,这些特征与大B细胞淋巴瘤(LBCL)患者在治疗后的反应以及是否产生副作用有关。研究小组还发现,CAR T细胞治疗一周后循环肿瘤DNA的早期改变可能预示着特定患者的治疗反应。该论文发表在《Nature Medicine》杂志上。
这项研究表明,在治疗的第一周内,临床医生可能能够识别出可能会有更差的结果或不良治疗反应的部分患者。这将使护理团队能够调整疗法以提高疗效或减轻毒性。
对于这项研究,研究人员对CAR T细胞进行了单细胞分析,以研究注入细胞中的基因表达谱。在治疗24例LBCL患者后,从输液袋中剩余的细胞中收集CAR T细胞。将这些基因图谱与输注后三个月通过PET / CT扫描确定的治疗反应进行比较。
“当我们观察注入的CAR T细胞的特征时,我们发现对治疗反应较差的患者的样本中T细胞已经耗竭,而完全康复的患者的样本中的T细胞表达了'记忆'信号。”通讯作者Sattva Neelapu,医学博士,淋巴瘤和骨髓瘤教授说道:“另外,在表现较差的患者中更常见的是T细胞衰竭这一细胞特征,而较差的分子反应通常与较低的阳性长期结果相关。”
13.Nat Immunol:转录因子BATF3改善CD8+ T细胞存活和免疫记忆
doi:10.1038/s41590-020-0786-2
德国维尔茨堡大学系统免疫学研究所的Wolfgang Kastenmueller教授和Georg Gasteiger教授的研究重点是免疫系统与机体的相互作用,特别是免疫系统的不同细胞在局部网络内的相互作用以及与其他器官系统中的细胞之间的相互作用。
在一项新的研究中,Kastenmueller及其团队破译了免疫系统发挥功能的新细节,这些细节对于免疫系统记住近期的感染很重要。相关研究结果于2020年9月28日在线发表在Nature Immunology期刊上,论文标题为“BATF3 programs CD8+ T cell memory”。他们的发现可能有助于改善对肿瘤疾病的免疫治疗。
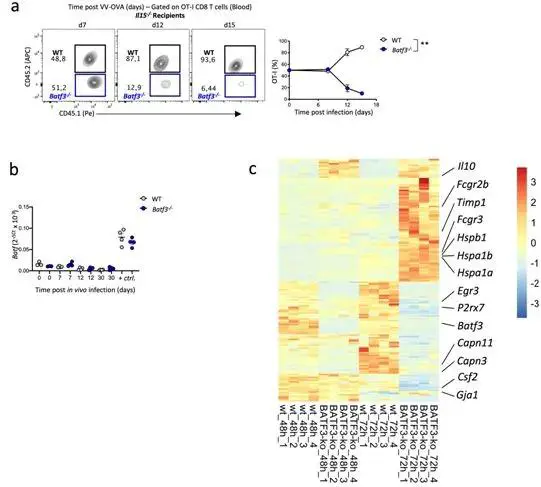
图片来自Nature Immunology, 2020, doi:10.1038/s41590-020-0786-2。
Kastenmueller介绍了他的研究的主要结果,“在这项研究中,我们鉴定出一种转录因子---BATF3,它非常特异性地调节这些细胞的存活,及其转换到记忆反应。”这些研究人员证实这种转录因子只有在T细胞初始激活后不久才会产生。这种转录因子的缺失会导致记忆反应的永久性失灵。 在此之前,这种转录因子对于所谓的CD8+ T细胞的作用还不清楚。仅在这些研究人员在CD8+ T细胞中过量表达这种转录因子后,它的重要性才变得清晰起来,这是因为他们可以观察到这些细胞存活下来,从而使得免疫记忆得到显着改善。 这项研究将基础研究与应用医学结合起来,可能有助于利用患者的免疫系统开发更好的癌症治疗方法,比如所谓的CAR-T细胞疗法。
CAR-T交流群来啦,在”泽平科技“公众号发送“加群”立马进群!
